
 |
Per il principio zero, quando un corpo viene posto a contatto con un altro corpo relativamente più freddo, avviene una trasformazione che porta a uno stato di equilibrio, in cui sono uguali le temperature dei due corpi. Per spiegare questo fenomeno, gli scienziati del XVIII secolo supposero che una sostanza, presente in maggior quantità nel corpo più caldo, passasse nel corpo più freddo. Questa sostanza ipotetica, detta "calorico", era pensata come un fluido capace di muoversi attraverso la materia. Il primo principio della termodinamica invece identifica il calore come una forma di energia che può essere convertita in lavoro meccanico ed essere immagazzinata, ma che non è una sostanza materiale. Quando un sistema acquista energia in conseguenza di una trasmissione di calore dall' esterno, o di un compimento di lavoro sul sistema per opera dell' esterno, l' energia interna aumenta. Il primo principio è dunque un principio di conservazione dell' energia. Esso afferma che, poiché l' energia non può essere né creata né distrutta, la somma della quantità di calore ceduta a un sistema e del lavoro compiuto sul medesimo deve essere uguale all' aumento dell' energia interna del sistema stesso. Calore e lavoro sono i mezzi attraverso i quali i sistemi si scambiano energia. Più formalmente quando un sistema assorbe una quantità di calore Q e compie una quantità di lavoro W, l' energia interna varia della seguente quantità:
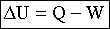
Il calore Q è positivo se è assorbito dal sistema; il lavoro W è positivo se fatto dal sistema. Un sistema può interagire con l' esterno in diversi modi, e il calore e il lavoro che intervengono ubbidiscono sempre al primo principio della termodinamica. In ciascun caso si suppone che la trasformazione sia una trasformazione quasi statica, cioè che si svolga talmente lentamente quanto basta affinché in tutte le regioni del sistema esistano una pressione e una temperatura uniformi nel tempo. Le trasformazioni termiche possono essere:
Naturalmente queste trasformazioni si possono combinare formando dei cicli.

Per saperne di più consulta i seguenti approfondimenti:
Tutto quanto riportato in questa pagina è a puro scopo informativo personale. Se non ti trovi in accordo con quanto riportato nella pagina, vuoi fare delle precisazioni, vuoi fare delle aggiunte o hai delle proposte e dei consigli da dare, puoi farlo mandando un email. Ogni indicazione è fondamentale per la continua crescita del sito.